چطور رنگینه ها رنگ ها را نشان می دهند؟ (پدیده مزدوج شدن)
WHY DYES SHOW COLOR (CONJUGATION)

چرا اکثر مولکول های آلی هیچگونه رنگی ندارند؟
مولکول های آلی در ناحیه ماوراء بنفش، نور را جذب می کنند. براساس تئوری رنگ ها می دانیم که در این صورت ما اشیا را به رنگ زرد خواهیم دید؛ زیرا در این حالت رنگ زرد که مکمل رنگ بنفش است، جذب و منعکس می شود.
قسمت اعظم طیف مرئی در محدوده طول موج 400 تا 700 نانومتر قرار دارد. بنابراین برای اینکه رنگ اجسام دیده شود؛ جسم باید طول موج های این ناحیه را جذب کند. اما مولکول های آلی نمی توانند این کار را انجام دهند.
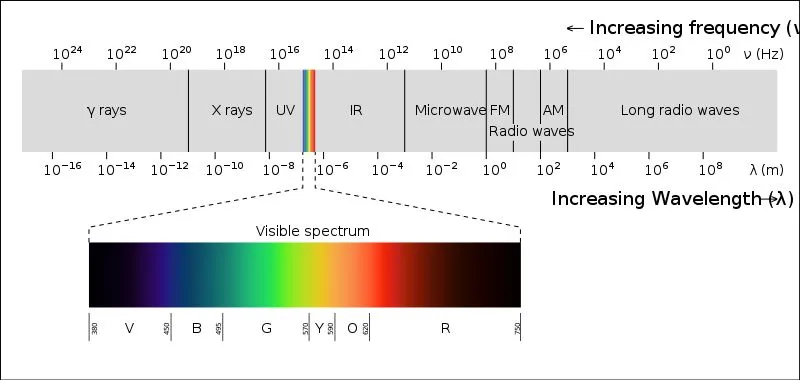
مولکول های آلی در حالت کلی طول موج های نور ماوراء بنفش که کمتر از 400 نانومتر هستند را جذب می کنند؛ در نتیجه هیچگونه رنگی از خود بروز نمی دهند.
چرا رنگینه ها رنگ دارند؟
اگر بخواهیم در یک کلمه پاسخ بدهیم؛ باید بگوییم دلیل رنگ داشتن رنگینه ها «مزدوج شدن» است. پس بیایید ببینیم مزدوج شدن به چه معناست.
چنانچه الکترون های pi در اوربیتال های p بتوانند با 3 یا بیش از 3 اتم شریک شوند؛ مولکول مزدوج می گردد. چنین چیزی با پیوندهای تکی و دوگانه امکان پذیر است. با این کار زمینه برای عدم استقرار الکترون های pi در تمام اوربیتال های p تراز مجاور فراهم می شود. الکترون های pi به یک پیوند یا اتم واحد تعلق ندارند؛ بلکه به گروهی از اتم ها وابسته هستند. یکی از ساده ترین مولکول های مزدوج، بوتادین 1.3 است.
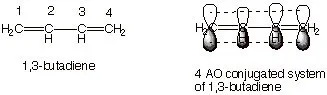
توجه داشته باشید که
- مولکول های مزدوج از نظر انرژی و پایداری در سطح پایینی قرار دارند.
- تفاوت انرژی بین HOMO (بالاترین اوربیتال مولکولی اشغال شده) و LUMO (پایین ترین اوربیتال مولکولی آزاد) کم است.
- با مزدوج شدن مولکول های آلی، رنگ ایجاد می شود.
یک مولکول چه زمانی رنگ ساطع می کند؟
انرژی نور وابسته به طول موج آن است. وقتی پرتو نور به مولکول برخورد می کند؛ الکترون ها از طریق اوربیتال مولکولی پیوندی به طور موقت به اوربیتال مولکولی ضد پیوندی می روند؛ از این رو انرژی را جذب می کند که به ما می گوید چه طول موج نوری توسط مولکول جذب شده است. اگر طول موج نور جذب شده در ناحیه طیف مرئی (400 تا 700 نانومتر) قرار بگیرد؛ می توان رنگ شی را مشاهده کرد. دقیقاً به همین دلیل است که رنگینه ها رنگ دارند.
مکانیسم انتشار طول موج قابل مشاهده نور
می دانیم که:

معادله مذکور نشان می دهد که انرژی با طول موج نسبت عکس دارد.
بنابراین هر چه فاصله بین HOMO و LUMO کمتر باشد؛ طول موج نور جذب شده بیشتر است.
حال بیایید طول موج ناشی از انرژی برخی از مولکول ها را محاسبه کنیم؛ مثل
طول موج ساطع شده از مولکول اتیلن
شامل دو اوربیتال p و در نتیجه دو اوربیتال اتمی است، و طبق نظریه MO، دو اوربیتال اتمی سبب تشکیل دو اوربیتال مولکولی می شوند که یکی از آنها پیوندی و دیگری ضد پیوندی است. تفاوت انرژی بین این دو اوربیتال 173 کیلو کالری بر مول است. بنابراین با قرار دادن این عدد در معادله فوق به طول موج 165 نانومتری می رسیم که در محدوده ماوراء بنفش قرار می گیرد.
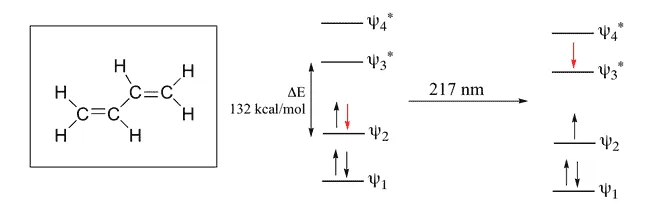
طول موج ساطع شده از بوتادین 1.3
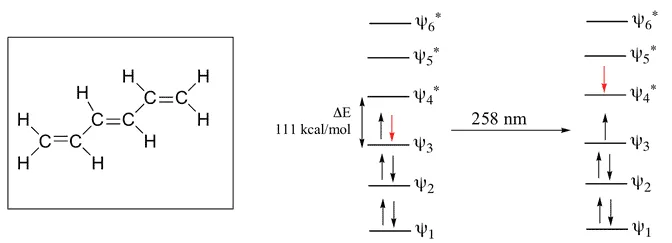
در اینجا Pi 4 اوربیتال اتمی = Pi 4 اوربیتال مولکولی است که در آن 2 اوربیتال پیوندی و 2 اوربیتال دیگر ضد پیوندی می باشد. تفاوت انرژی بین این دو مدار 132 کیلو کالری بر مول است. طول موج مربوط به این مقدار 217 نانومتر است که در محدوده ماوراء بنفش قرار دارد.
طول موج ساطع شده از هگزاترین 3.5
در اینجا Pi 6 اوربیتال اتمی = Pi 6 اوربیتال مولکولی است که در آن 6 اوربیتال پیوندی و 6 اوربیتال ضد پیوندی هستند. تفاوت انرژی بین این دو مدار 111 کیلو کالری بر مول است. طول موج مربوط به این مقدار 258 نانومتر است که در محدوده ماوراء بنفش قرار می گیرد.
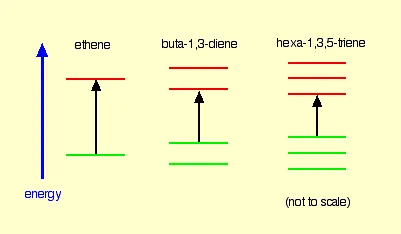
حال اجازه بدهید این 3 مولکول را با هم مقایسه کنیم:
همان طور که معلوم است هر چه مزدوج بودن یا عدم استقرار و یا پیوستگی بیشتر باشد، شکاف انرژی بین HOMO و LUMO کمتر است؛ از این رو طول موج افزایش می یابد.
حال بیایید مولکولی آلی را بررسی کنیم که رنگی به نظر می آید:
چرا بتا کاروتن رنگی است؟
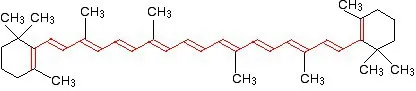
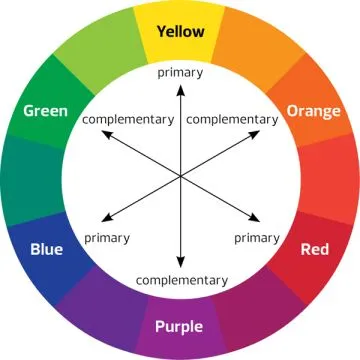
مولکول بتا کاروتن (Beta Carotene) که در هویج یافت می شود دارای 11 کربن مزدوج است؛ در نتیجه شکاف انرژی آن بسیار کم است. این مولکول طول موج نور را در 455 نانومتر جذب می کند. بنابراین رنگ آبی را جذب می نماید و رنگ مکمل آن که نارنجی است را منعکس می کند. (در قسمت فوق می توانید شکل رنگ های مکمل را مشاهده کنید).
کاربردهای پدیده مزدوج
- ایجاد شاخصه های پایه اسیدی مانند فنل فتالئین، متیل نارنجی و غیره. (در اینجا پدیده مزدوج مرتبط با pH به ترتیب افزایش و کاهش می یابد).
- سنتز رنگ هایی مانند ارغوانی بنفش، نیلی و غیره.
- فرآیند سفید کاری (در اینجا سفید کننده فقط مزدوجی ذرات خاک یا لکه را از بین می برد؛ از این رو نمی توان کثیفی ها را مشاهده کرد، هر چند هنوز وجود دارند).
- بیشتر در شرکت های تولید رنگینه ها از این اصل استفاده می شود.
امیدواریم پس از خواندن این مقاله متوجه شده باشید که چرا رنگینه ها رنگی هستند. برای اطلاعات بیشتر در مورد رنگینه ها می توانید مطلب “رنگینه ها و انواع مختلف آنها” مراجعه نمایید.














